Novavax: VERKAUF erwägenswert – Droht in den USA ein ähnliches Desaster wie bei CureVac?
Ein US-Zulassungsfehlschlag wäre verheerend

Auch heute stürzt die Aktie von NOVAVAX, die nun seit ihrem Top von 244 USD im März 2021 sogar stärker korrigiert hat (- 65 %) als ihre direktesten aktiven oder potenziellen Corona-Impfstoff-Konkurrenten BIONTECH (Abstand vom Top in US-Dollar: - 55 %), MODERNA (- 58 %) oder VALNEVA (- 43 %) um weitere – 10,5 % auf nur noch 116,50 USD ab. Die Verletzung der kritischen 120 USD-Marke (sowohl das Doppeltief vom Mai und Oktober 2021 wie auch die erstmalige signifikante Unterstützung ihres seit Mai 2020 etablierten steilen Primäraufwärtstrends) stellt damit ein weiteres alarmierendes Korrektursignal dar.
Auf den ersten Blick erscheint diese merklich schlechtere Aktienperformance von NOVAVAX (US6700024010) als ihre derzeit direktesten aktiven oder potenziellen Corona-Impfstoffkonkurrenten BIONTECH (US09075V1026), MODERNA (US60770K1079) oder VALNEVA (FR0004056851) überraschend und schwer erklärbar.
Denn der bereits 1987 gegründete Konzern mit Sitz im US-Bundesstaat Maryland erzielte als mittlerweile erster bereits international stark zugelassener Hersteller eines Corona-Totimpfstoffs (Basis ist ein aus Insektenzellen gewonnenes SARSCoV2-Spike Protein mit anschließender Virus-Betazellenabtötung zur Ausschaltung jeglicher weiterer Virenausbreitung und -symptomatik, jedoch dennoch ausgelöster Aktivierung einer menschlichen Immunreaktion auf dieses Spike Protein) mit der gestern in Südkorea ergangenen Zulassungsgenehmigung nun die weltweit bereits 31. Landeszulassung seines Totimpfstoffs mit der Markenbezeichnung NUVAXOVID.
Diese Noteinsatzgenehmigung (Emergency Use Authorization / EUA) war in den letzten Wochen auch vor allem bereits durch viele weitere andere asiatische Länder wie z.B. Indien, die Philippinen und Indonesien sowie seit 20.12. nun auch durch die EU-Kommission nach entsprechender Empfehlung der Europäischen Arzneimittel-Agentur EMA ergangen.
 Zudem lieferten auch die Studien-Testergebnisse von NUVAXOVID unmittelbar vor den jeweiligen weltweiten Zulassungsbeantragungen hervorragende Ergebnisse, die den seinerzeitigen Testresultaten der Vakzine COMIRNATY von Pfizer/BioNTech und SPIKEVAX von Moderna vollauf ebenbürtig waren (90 %ige weitere Infektionsverhinderung nach Erhalt der 2 Basisimpfungen, zudem 100%ige Reduktion sowohl milder wie selbst auch schwerer Infektionsverläufe im sehr seltenen Fall einer späteren nochmaligen Corona-Infektion) und besitzt NUVAXOVID sogar auch den weiteren Vorzug, dass dieses Vakzin wegen der grundsätzlich weit geringeren Aggressivität und Immunsystembelastung eines Totimpfstoffverfahrens, anders als insbesondere die auf aktiven Virensträngen beruhenden mRNA-Impfstoffe von BIONTECH und MODERNA, bereits schon seit seiner Entwicklung wochenlang bei jeglicher normalen Kühlschranktemperatur lager- und transportierbar ist.
Zudem lieferten auch die Studien-Testergebnisse von NUVAXOVID unmittelbar vor den jeweiligen weltweiten Zulassungsbeantragungen hervorragende Ergebnisse, die den seinerzeitigen Testresultaten der Vakzine COMIRNATY von Pfizer/BioNTech und SPIKEVAX von Moderna vollauf ebenbürtig waren (90 %ige weitere Infektionsverhinderung nach Erhalt der 2 Basisimpfungen, zudem 100%ige Reduktion sowohl milder wie selbst auch schwerer Infektionsverläufe im sehr seltenen Fall einer späteren nochmaligen Corona-Infektion) und besitzt NUVAXOVID sogar auch den weiteren Vorzug, dass dieses Vakzin wegen der grundsätzlich weit geringeren Aggressivität und Immunsystembelastung eines Totimpfstoffverfahrens, anders als insbesondere die auf aktiven Virensträngen beruhenden mRNA-Impfstoffe von BIONTECH und MODERNA, bereits schon seit seiner Entwicklung wochenlang bei jeglicher normalen Kühlschranktemperatur lager- und transportierbar ist.
Novavax im Strudel ungünstiger Marktbedingungen + ungeklärter FDA-Zulassung
Auf den ersten Blick stellt dies vermeintlich exzellente Voraussetzungen dar, dass auch NOVAVAX und seiner Aktie ein ähnlicher Anfangserfolg nach seiner Erstzulassung hätte beschieden sein sollen, wie dies seinerzeit auch für BIONTECH und MODERNA galt, zumal die EU im Zuge der erfolgten Zulassung bis Ende 2023 nun auch bereits schon 200 Mio. Dosen des Vakzins NUVAXOVID geordert hat. Doch in der Praxis war bei NOVAVAX hiervon bislang kaum eine Spur zu sehen, und das hat im Einzelnen in diesem Fall gleich mehrere gute (oder vielmehr schlechte) Gründe:
Zum einen lasteten natürlich auch auf NUVAXOVID praktisch zu jeder Zeit identisch jene aktuellen Zeit- und Strukturprobleme, die deckungsgleich auch vor allem ihrem direktesten Totimpfstoff-Konkurrenten VALNEVA zu schaffen machten und die wir nun schon mehrfach in unseren zurückliegenden Analysen (z.B. hier) aufgeführt hatten:
Nämlich vor allem die vergleichsweise geringe, eher grippeähnliche Symptomatik der aktuell alles beherrschenden und weltweit aber auch immer stärker grassierenden Omikron-Variante des Corona-Virus wie aber auch die in der letzten Dezember-Woche erfolgten FDA-Zulassungen der offenbar hoch wirksamen Corona-Medikamente PAXLOVID (Pfizer) und in geringerem Maße MOLNUPIRAVIR / LAGEVRIO (Merck & Co.), was natürlich per se schon einmal den Bedarf oder auch die Nachfrage nach künftigen weiteren Impfstoffverabreichungen deutlich senken könnte.
Ferner dürfte außerdem auch auf NOVAVAX, ebenso wie dies für VALNEVA galt, negativ ausgestrahlt haben, dass aktuelle Erststudien des ähnlich aufgebauten chinesischen Totimpfstoffs CoronaVac nicht die geringsten Erkenntnisse über dessen Wirksamkeit auch gegen die Omikron-Variante des Corona-Virus ergaben (nahezu keinerlei Bildung neutralisierender Antikörper nach Impfstoffverabreichungen), so dass die Marktteilnehmer hieraus auch für Novavax den fraglos ebenso denkbaren Schluss zogen, auch ihr Vakzin könnte (anders als z.B. bisherige Verlautbarungen von BioNTech – 25%ige Antikörpererhöhungen nach Erhalt einer jeweils 3. Booster-Impfung – und Moderna) sich gegen die Omikron-Variante künftig ebenfalls als genauso wirkungslos erweisen.
Manko der Totimpfstoffe: Medizinische Empfehlungen eher für Booster- anstatt Basisimpfungen
Darüber hinaus empfehlen Mediziner außerdem derzeit weltweit überwiegend und vollauf nachvollziehbar, sollten Totimpfstoffe wie von Novavax und Valneva trotz ihres kritischen Zeitnachteils künftig überhaupt zum Einsatz kommen, dass diese dann wegen ihrer naturgemäß schwächeren Immunabwehr-Aktivierung (trotz Zusetzung wirkungsverstärkender sog. Matrix-Adjuvans-Substanzen zu diesen Impfstoffen) weit vorrangig fast nur zu kombinatorischen Booster-Drittimpfungen oder bei gravierenden Vorerkrankungsschädigungen zum Einsatz kommen sollten, aber üblicherweise eben gerade nicht oder in jedem Fall nur nachrangig zu den herkömmlichen und natürlich weit volumensstärkeren Basis-Erst- und Zweitimpfungen (weiterhin klar dominiert durch die mRNA-Vakzine von BioNTech und Moderna).
Auch dies kann aus medizinischer Sicht natürlich ein sehr ernstzunehmender Faktor sein, der einer weitverbreiteten und sehr volumensstarken Anwendung der Vakzine von Novavax und Valneva künftig entscheidend im Wege stehen könnte.
Sind all diese möglichen künftigen Einsatz-Unwägbarkeiten der Impfstoffe gerade von Valneva und Novavax deren Aktien derzeit nicht schon abträglich genug (bei Valneva existiert wenigstens derzeit noch die Möglichkeit einer EU- sowie UK-Zulassung noch in diesem Quartal, bei Novavax läuft die UK-Zulassungsprüfung derzeit noch), so hat Novavax derzeit noch mit einem weit gravierenderen Problem ausgerechnet in ihrem perspektivisch sicher wichtigsten Absatzmarkt, nämlich gerade ihrem Heimatland USA, zu kämpfen:
Denn während bei Valneva derzeit die Zulassung ihres Impfstoffs VLA2001 in den USA sowieso bislang noch in keiner Weise auf der Agenda stand oder der französische Konzern dies angekündigt hatte, war eine solche Zulassungs-Antragsstellung in den USA bereits schon seit Frühjahr/Sommer 2021 stets vehement von Novavax angekündigt worden, scheiterte aufgrund offensichtlicher massiver Produktions- und Auslieferungsprobleme von NUVAXOVID in den USA (nach Angaben der prominenten US-Zeitschrift Forbes sei es hierbei zurückliegend sogar zu einer direkten Verletzung vertraglich festgelegter Qualitätsstandards gekommen) jedoch bislang ständig und wurde nun Ende Dezember von Novavax ein weiteres Mal, vermutlich nun auf Ende Januar, verschoben.
Sollte sich an dieser Hängepartie gerade der Zulassungserteilung durch die FDA für ihren US-amerikanischen Heimatkonzern auch in den kommenden Wochen nichts ändern, wäre dies nicht nur aus Imagegründen gerade für NOVAVAX und seine Aktie ein völliges Desaster (natürlich immens stärker als für VALNEVA), sondern könnten dem Konzern aus unserer Sicht – und vermutlich auch von anderen Marktteilnehmern befürchtet – möglicherweise empfindliche Schadensersatzforderungen drohen, da die NUVAXOVID-Produktion bislang nicht nur durch die US-Regierung im Rahmen ihres Programms „Warp Speed“ mit bisher stolzen 1,6 Mrd. USD, sondern auch noch von der Bill & Melinda Gates-Stiftung mit weiteren 400 Mio. USD unterstützt wurde. Überdies hat Novavax auch mit den USA bereits die verbindliche Auslieferung von 100 Mio. Impfdosen noch für dieses Jahr ausgehandelt.
US-Perspektiven für Novavax täglich kritischer, Aktienverkauf daher erwägenswert
Die derzeitigen Geschäftsperspektiven von NOVAVAX stufen wir daher, gerade aufgrund ihrer aktuellen spezifischen USA-Problematik sowie den außerdem ähnlich wie bei BioNTech durchweg fehlenden alternativen profitablen Geschäftsfeldern, momentan als noch kritischer ein, als dies selbst für die auch noch mit weiteren profitablen Randaktivitäten ausgestattete Valneva zu attestieren ist.
 Im schlimmsten Falle könnte – zumindest was ihren Heimatmarkt USA angeht, schließlich erteilt gerade die hierin sehr kritische FDA grundsätzlich nur und erst bei nachweislich 100 %ig gesicherten Produktions- und Auslieferungsstrukturen jeweilige Zulassungen – NOVAVAX in den nächsten Wochen bis Monaten sogar ein hierzulande sicher noch bestens bekanntes „CUREVAC Revisited“-Debakel drohen, deren hierauf sicherlich unweigerlich folgender, endgültiger Aktiencrash wohl leicht auszumalen wäre.
Im schlimmsten Falle könnte – zumindest was ihren Heimatmarkt USA angeht, schließlich erteilt gerade die hierin sehr kritische FDA grundsätzlich nur und erst bei nachweislich 100 %ig gesicherten Produktions- und Auslieferungsstrukturen jeweilige Zulassungen – NOVAVAX in den nächsten Wochen bis Monaten sogar ein hierzulande sicher noch bestens bekanntes „CUREVAC Revisited“-Debakel drohen, deren hierauf sicherlich unweigerlich folgender, endgültiger Aktiencrash wohl leicht auszumalen wäre.
Von einem Engagement in der NOVAVAX-Aktie raten wir daher nach heutiger Verletzung der kritischen 120 USD-Marke momentan strikt ab und empfehlen, bestehende Positionen derzeit sogar intensiv auf einen Verkauf hin zu überprüfen.
Chart: NOVAVAX (in US-Dollar)
13.01.2022 - Matthias Reiner
Auf Twitter teilen Auf Facebook teilen
Informiert bleiben - Wenn Sie bei weiteren Nachrichten und Analysen zu einem in diesem Artikel genannten Wert oder Unternehmen informiert werden möchten, können Sie unsere kostenfreie Aktien-Watchlist nutzen.
Folgende Artikel könnten Sie auch interessieren
Ihre Bewertung, Kommentar oder Frage an den Redakteur
Bewertungen, Kommentare und Fragen an den Redakteur
Haftungsausschluss - Die EMH News AG übernimmt keine Haftung für die Richtigkeit der Empfehlungen sowie für Produktbeschreibungen, Preisangaben, Druckfehler und technische Änderungen. (Ausführlicher Disclaimer)



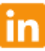



 10.05.2023
10.05.2023
 12.09.2022
12.09.2022
 19.08.2022
19.08.2022
 09.08.2022
09.08.2022